1 micromètre c'est 10-6 mètres.
1é micromètes c'est 12*10^-6 ou 1.2*10^-5m (chiffres significatifs)
12*10^-5 m c'est 10^-8km (1m=10^-3km)
Aide aux devoirs
Ivy Maital
- Membre

- 13331 posts
Vvn Niger
- Membre

- 17725 posts
23 septembre 2012, 18:54
C'est déjà plus clair, thx. J'avais pas tilté que 10^-6 ça correspondait au micromètre. Par contre :

1é micromètes c'est 12*10^-6 ou 1.2*10^-5mLà j'ai pas pigé. Comment on passe de -6 à -5 ?

Ivy Maital
- Membre

- 13331 posts
23 septembre 2012, 18:56
12*10^-6 c'est 1.2*10*10^-6
Et 10^-6*10 c'est 10^-5 (10^(-6+1))
Et 10^-6*10 c'est 10^-5 (10^(-6+1))
valentin buck
- Membre

- 20862 posts
23 septembre 2012, 19:01
ben micro c'est 10^-6 point barre tg
Kotaro
- Membre

- 4605 posts
23 septembre 2012, 22:07
niquez vos mères avec les maths
valentin buck
- Membre

- 20862 posts
23 septembre 2012, 22:09
pk tu parles, t'es un futur journaliste de libération/rue89 

Kotaro
- Membre

- 4605 posts
23 septembre 2012, 22:14
Mais non, tu sais bien que je rêve de travailler chez Valeurs Actuelles buck ..
faer
- Membre
- 4432 posts
23 septembre 2012, 22:17
C'est juste que personne n'a besoin d'aide pour faire un truc littéraire.
Vvn Niger
- Membre

- 17725 posts
23 septembre 2012, 22:33
y'a rien de plus relou que les maths dsl
valentin buck
- Membre

- 20862 posts
23 septembre 2012, 22:51
tu dis ça psk t'es nul
-S@M-
- Membre

- 5367 posts
24 septembre 2012, 23:21
ben là pas le choix faut connaître la relation entre tes unités, avec un rapport 10^3 c'est dans l'ordre: km > m > mm > µm
donc des micromètres aux mètres, t'as un rapport 10^-6, aux kilomètres, 10^-12.
Par contre la solution n'est pas en kilomètres, faudrait ajouter -3 à l'exposant donc t'aurais 12µm = 1.2*10^-8 km
edit: woops, j'avais pas vu que j'étais pas sur la dernière page sry :/
« Modifié: 24 septembre 2012, 23:22 par -S@M- »
donc des micromètres aux mètres, t'as un rapport 10^-6, aux kilomètres, 10^-12.
Par contre la solution n'est pas en kilomètres, faudrait ajouter -3 à l'exposant donc t'aurais 12µm = 1.2*10^-8 km
edit: woops, j'avais pas vu que j'étais pas sur la dernière page sry :/
Efferalgan
- Membre

- 4020 posts
03 octobre 2012, 18:38
Je prends un irrationnel x, il me faut une suite de rationnels qui converge vers x.
Je vois pas comment faire.
Je vois pas comment faire.
Carreaux
- Membre
- 5188 posts
03 octobre 2012, 19:01
J'ai un livre méga chiant à lire.
Efferalgan
- Membre

- 4020 posts
03 octobre 2012, 19:57
Je peux pas t'aider dsl.
Personne pour ma suite ?
Personne pour ma suite ?
𝑻𝒚𝒆𝒍
- Membre
- 8516 posts
-S@M-
- Membre

- 5367 posts
03 octobre 2012, 22:12
« Modifié: 03 octobre 2012, 22:13 par -S@M- »
Je peux pas t'aider dsl.il y en a des tonnes mec, tu prends simplement une suite qui converge vers 0 et tu lui additionne ton irrationnel (genre x+1/i). mais c'est sûrement pas ce genre de truc que tu cherches donc précise.
Personne pour ma suite ?
Ivy Maital
- Membre

- 13331 posts
03 octobre 2012, 22:14
Non mais Efferalgan il a passé la prépa, donc si c'était aussi simple, je suis pas sur qu'il demanderait.
-S@M-
- Membre

- 5367 posts
03 octobre 2012, 22:15
c'est pour ça que je lui demande de préciser parce que mon truc entre parenthèse répond parfaitement à sa question donc c'est sûrement mal formulé.
Efferalgan
- Membre

- 4020 posts
03 octobre 2012, 23:43
Si x est irrationnel, x+1/n l'est aussi. Donc non.
Je savais qu'il y avait un truc simple, mais j'arrivais pas à mettre le doigt dessus. En fait, il suffisait de prendre le développement décimal.
Je savais qu'il y avait un truc simple, mais j'arrivais pas à mettre le doigt dessus. En fait, il suffisait de prendre le développement décimal.
Efferalgan
- Membre

- 4020 posts
03 octobre 2012, 23:45
Je suis désormais en mesure de prouver à mon prof de maths que j'ai raison et qu'il a tort.
Carreaux
- Membre

- 5188 posts
04 octobre 2012, 17:34
hihi page 69
The Miz
- Membre
- 19276 posts
04 octobre 2012, 19:53
Je dois faire mon premier taff de l'année et je suis grave dans la merde. Je dois faire une revue d e presse en anglais, mais j'ai ni le temps ni la motivation.
Sauvez moi, filez moi un sujet cool svp.
Sauvez moi, filez moi un sujet cool svp.
Cocktail monotone
- Membre
- 13874 posts
06 octobre 2012, 09:40
Help
En physique la prof' nous a cité Boyle Mariotte, et a demandé qui connaissait. J'ai levé la main, et j'ai dit que ça servait pour la plongée, merci Ivy. Sauf que maintenant elle va peut être m’interroger dessus la semaine prochaine, et quand je quand je lis le machin je comprends rien
Quelqu'un a des explications simples ?
En physique la prof' nous a cité Boyle Mariotte, et a demandé qui connaissait. J'ai levé la main, et j'ai dit que ça servait pour la plongée, merci Ivy. Sauf que maintenant elle va peut être m’interroger dessus la semaine prochaine, et quand je quand je lis le machin je comprends rien
Quelqu'un a des explications simples ?
Efferalgan
- Membre

- 4020 posts
06 octobre 2012, 09:55
T'as la loi des gaz parfaits, qui te dit que PV=nRT, avec P pression, V volume, n quantité de matière, R une constante, T température.
Boule-Marriotte te dit simplement que pour une quantité de gaz donné (donc à n constant), pour une température (T) constante, PV est constant. Je pense que tu peux le démontrer tout seul.
Et donc, vu que le produit PV est constant, ça veut dire que si tu augmentés P, alors V diminue, et inversement.
Pour te représenter ça, tu prends une balle en mousse, si tu appuies dessus (augmentation de la pression), alors elle devient plus petite (diminution du volume).
Ça marche aussi peut-être avec des gaz non-parfaits, je sais pas en quelle classe tu es, mais je pense qu'osef.
Édit : oui donc ça marche avec tous les gaz, mais c'est plus chiant à démontrer. De toute façon, avant que vous en arrivez ne serait-ce qu'aux gaz de Van der Waals, tu as le temps. Et le modèle du gaz parfait est une approximation suffisamment proche de la réalité pour que tu puisses foutre tous les gaz dans cette catégorie pour le moment.
« Modifié: 06 octobre 2012, 10:02 par Efferalgan »
Boule-Marriotte te dit simplement que pour une quantité de gaz donné (donc à n constant), pour une température (T) constante, PV est constant. Je pense que tu peux le démontrer tout seul.
Et donc, vu que le produit PV est constant, ça veut dire que si tu augmentés P, alors V diminue, et inversement.
Pour te représenter ça, tu prends une balle en mousse, si tu appuies dessus (augmentation de la pression), alors elle devient plus petite (diminution du volume).
Ça marche aussi peut-être avec des gaz non-parfaits, je sais pas en quelle classe tu es, mais je pense qu'osef.
Édit : oui donc ça marche avec tous les gaz, mais c'est plus chiant à démontrer. De toute façon, avant que vous en arrivez ne serait-ce qu'aux gaz de Van der Waals, tu as le temps. Et le modèle du gaz parfait est une approximation suffisamment proche de la réalité pour que tu puisses foutre tous les gaz dans cette catégorie pour le moment.
Cocktail monotone
- Membre
- 13874 posts
06 octobre 2012, 09:57
Ah ok, donc j'avais déjà pas compris ça du tout dans ce que j'avais pas compris. Merci mec.
Efferalgan
- Membre

- 4020 posts
06 octobre 2012, 10:04
Putain enculé tu m'as fait refaire de la thermodynamique sans que j'y fasse gaffe alors que je m'étais juré de ne pas y toucher pendant au moins les 3 prochaines années.
Retrosasu
- Membre

- 27186 posts
06 octobre 2012, 10:09
C'était du niveau 2nde, on te blâmera pas pour ça je pense.
𝑻𝒚𝒆𝒍
- Membre
- 8516 posts
06 octobre 2012, 13:06
weby j'ai besoin de toi pour une confirmation
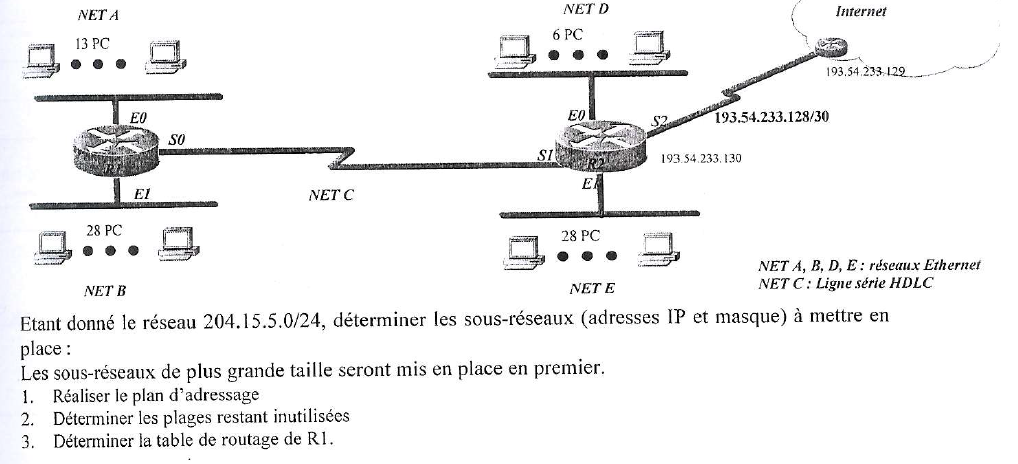
pour Net B /27 -> Net E /27 204.15.5.0
c'est ça ?

pour Net B /27 -> Net E /27 204.15.5.0
c'est ça ?
Weby
- Membre

- 56564 posts
𝑻𝒚𝒆𝒍
- Membre
- 8516 posts
06 octobre 2012, 13:18
ptain mais tu sais rien faire en fait
à part coder des trucs de merde en 15 lignes et brancher des câbles ethernet qu'est-ce que tu fais fdp
à part coder des trucs de merde en 15 lignes et brancher des câbles ethernet qu'est-ce que tu fais fdp
